
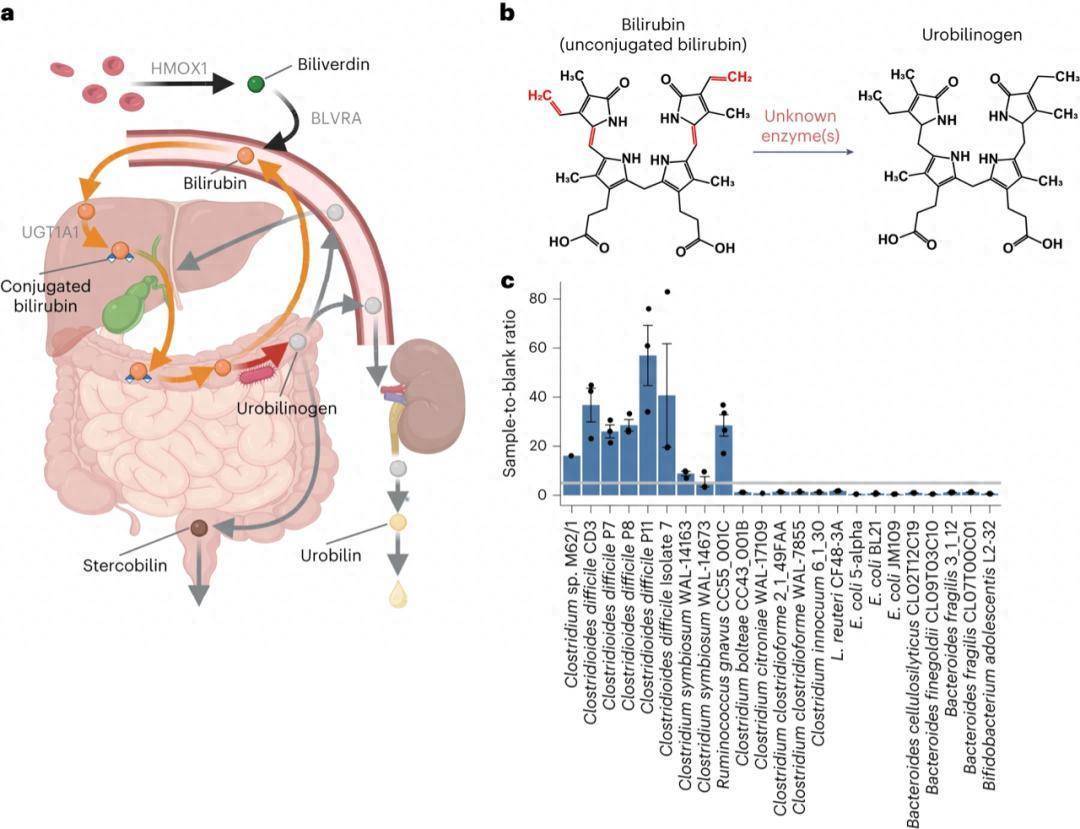
血红素代谢是人体核心生理过程,其副产物胆红素的稳态平衡直接关乎健康。胆红素主要由衰老红细胞中的血红蛋白降解产生富邦速配,经肝脏结合转化为结合型胆红素(胆红素二葡萄糖醛酸苷)后,随胆汁排入肠道。在肠道内,结合型胆红素可被人体或细菌的β-葡萄糖醛酸酶解偶联为非结合型胆红素,后者要么被重吸收进入肠肝循环,要么经肠道微生物还原为尿胆原和粪胆原,最终随粪便、尿液排出,完成血红素降解闭环。
适量胆红素是重要的抗氧化剂,具有潜在健康益处,但血清胆红素过量会引发黄疸,新生儿群体中严重时可导致核黄疸,造成不可逆的神经系统损伤;成年人中,胆红素代谢紊乱还与炎症性肠病(IBD)、肝胆结石等疾病密切相关。长期以来,肠道微生物将胆红素还原为尿胆原的关键步骤中,介导该反应的微生物酶一直未被鉴定,这一知识缺口严重限制了对肠肝轴调控机制的深入理解,也阻碍了相关疾病靶向治疗策略的开发。本研究通过多组学技术与功能验证相结合的系统方法,成功锁定肠道微生物来源的胆红素还原酶BilR,全面解析其催化机制、序列特征、物种分布及临床关联,为胆红素代谢相关疾病的干预提供了全新靶点与理论基础。
假定胆红素还原酶的鉴定
胆红素还原酶推测为作用于碳-碳双键的氧化还原酶(EC:1.3.-.-),且仅存在于具有胆红素还原活性的菌株中(图1b)。研究团队搭建了基于荧光信号的高通量筛选体系,核心原理是胆红素还原产物尿胆原/粪胆原易被碘氧化为稳定的尿胆素/粪胆素,尿胆素与醋酸锌形成的荧光复合物可被定量检测(非蛋白结合型胆红素无荧光),设定荧光强度与空白对照比值>5为阳性标准(图1c)。
通过对人类肠道核心菌群的筛选,最终鉴定出9株具有显著还原活性的菌株,包括3株首次报道的功能菌株(Clostridium symbiosum WAL-14163、Clostridium symbiosum WAL-14673、Ruminococcus gnavus CC55_001C),且所有活性菌株均隶属于厚壁菌门梭菌纲,其近缘菌株无还原活性(图1c)。作为阳性对照,已知还原菌株Clostridioides difficile CD3呈现阳性结果,未添加胆红素的培养体系无荧光产生(图1c)。
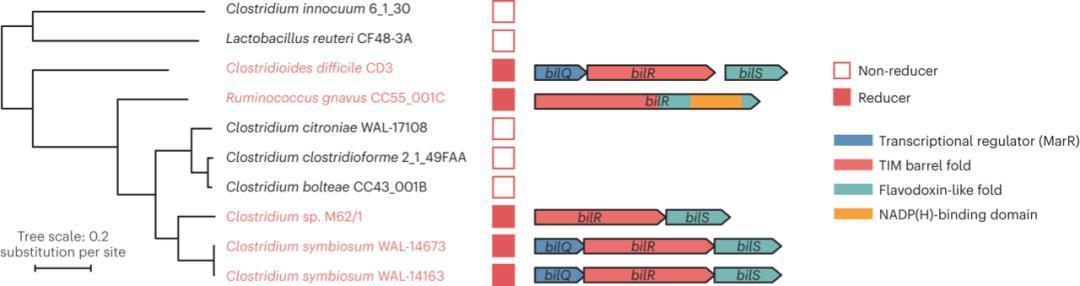
研究团队选取5株活性菌株与5株非活性近缘菌株进行全基因组比较分析富邦速配,通过Orthologer软件聚类得到6256个直系同源群,其中389个为氧化还原酶候选基因。经筛选,仅两个直系同源群的存在/缺失模式与还原表型完全匹配:一个是参与类异戊二烯合成的4-羟基-3-甲基丁-2-烯基二磷酸还原酶(不符合功能预期);另一个是未注释的酶基因,与2,4-二烯酰辅酶A还原酶(EC:[1.3.1.34])同源,具备碳-碳双键还原活性,被命名为bilR(假定胆红素还原酶基因)(图2)。
操纵子结构分析显示,bilR常与bilQ(MarR家族转录调控因子)、bilS(黄素氧还蛋白样蛋白)形成复合操纵子,存在三种核心组合形式:Clostridioides difficile CD3及两株Clostridium symbiosum含bilQ-bilR-bilS完整形式,Clostridium sp. M62/1含bilR-bilS简化形式,Ruminococcus gnavus CC55_001C仅含单一bilR基因(图2)。AlphaFold预测显示,Ruminococcus gnavus的BilR含N端TIM桶结构域(与其他bilR全长序列同源)及额外C端黄素氧还蛋白样结构域、NADP(H)结合结构域,Clostridium symbiosum的BilR与BilS具有相似折叠模式;且Ruminococcus gnavus的BilR与大肠杆菌2,4-二烯酰辅酶A还原酶(PDB:1PS9)具有明显的同源性(蛋白一致性29.82%,RMSD=2.79),进一步支持其催化功能。
BilR赋予胆红素还原酶活性
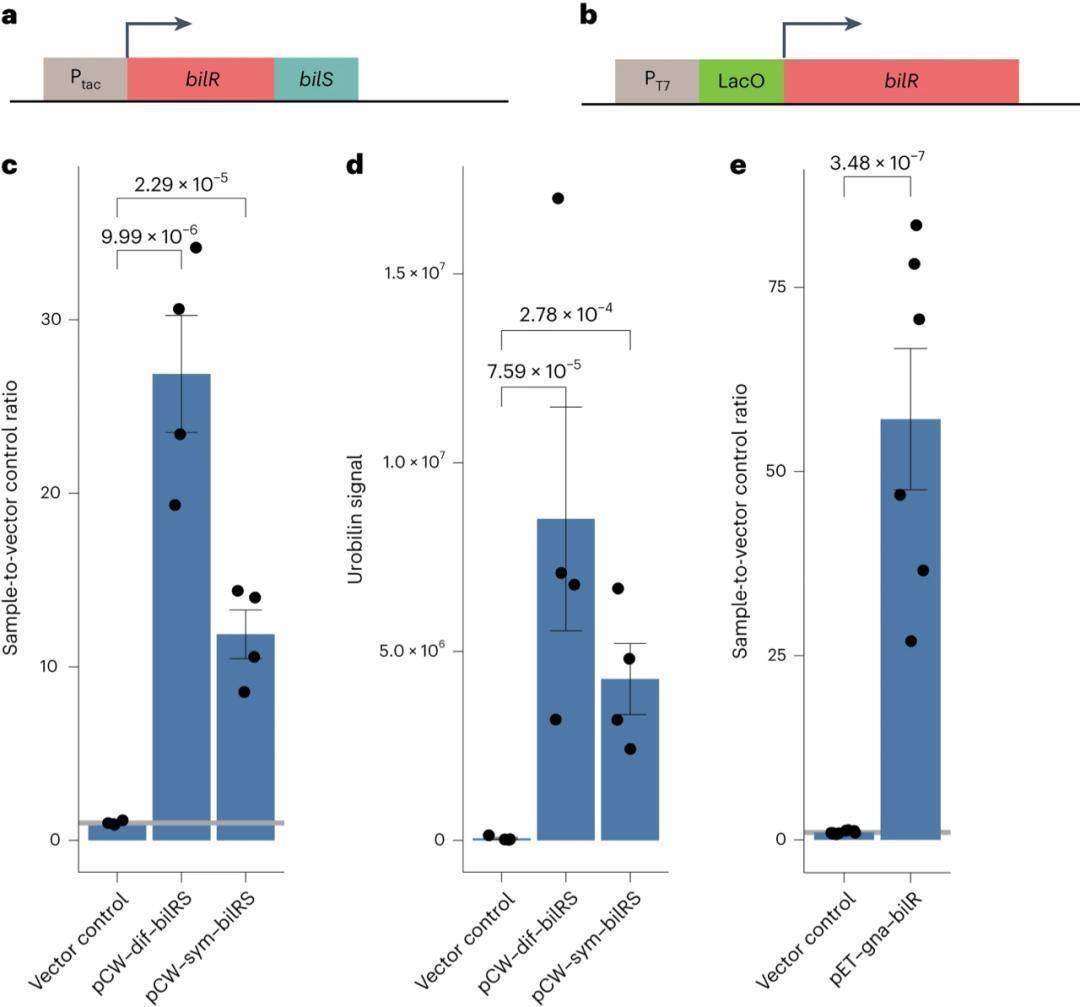
为验证BilR的催化功能,研究团队构建三种异源表达体系(图3a、3b)。荧光检测结果显示,表达两种短链bilRS及长链bilR的重组大肠杆菌,荧光信号均显著高于空载体对照组(图3c、3e);LC-MS/MS进一步验证,重组菌株样品中检测到尿胆素特征峰,未检测到粪胆素峰,证实荧光实验可可靠指示胆红素向尿胆原的还原(图3d),且空载体对照组无还原活性。此外,天然胆红素还原菌株与表达bilRS的大肠杆菌,还能有效催化中胆红素(胆红素结构类似物)的还原,表明BilR对胆红素类底物具有广泛催化适用性。
BilR分支的界定富邦速配
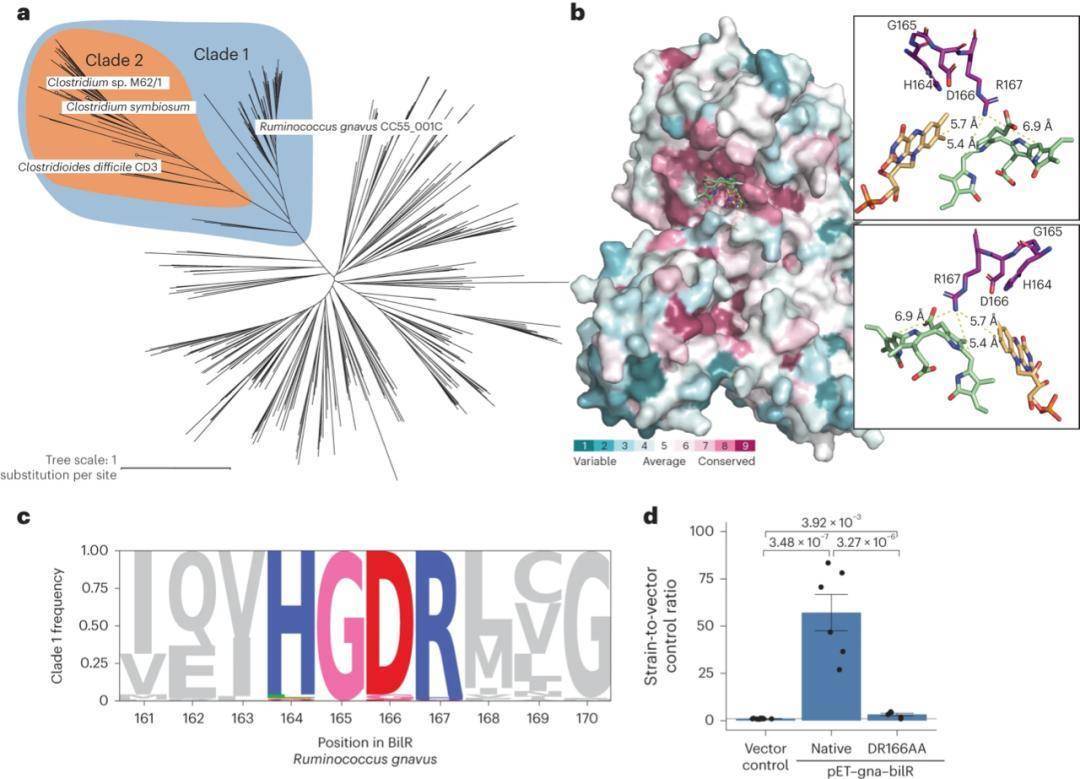
为区分BilR与古老黄酶家族其他成员,研究团队结合结构预测与序列保守性分析,鉴定出BilR的关键特征残基。AlphaFold预测显示,BilR的活性中心与大肠杆菌2,4-二烯酰辅酶A还原酶相似,后者的Y166残基负责为底物提供质子,而BilR中对应位置的R167及邻近D166残基推测为质子供体。序列比对发现,D166、R167与H164、G165共同构成保守的HGDR基序,该基序在所有已验证的BilR蛋白中高度保守(图4b、4c)。
构建BilR与古老黄酶家族相关还原酶的基因进化树,明确实验验证的胆红素还原酶集中于Clade 1(蓝色高亮),短链bilR变体形成独立的Clade 2(橙色高亮)(图4a)。为验证HGDR基序的功能,研究团队构建Ruminococcus gnavusbilR的定点突变体(D166A/R167A),圆二色谱分析显示突变体蛋白折叠结构与野生型一致(排除结构破坏影响),但荧光实验显示其还原活性显著下降,证实D166和R167是催化关键残基(图4d)。
基于HGDR基序及TIM桶结构域构建隐马尔可夫模型(HMM),在基因组分类数据库(GTDB)中鉴定出658个含BilR同源蛋白的菌株,主要集中于厚壁菌门,存在长短两种结构变体:短变体(约300-350个氨基酸,仅含TIM桶结构域)主要分布于厚壁菌门,长变体(约500-600个氨基酸,含额外黄素氧还蛋白样结构域和NADP(H)结合结构域)分布于多个门(图5)。其中Clostridium perfringens的胆红素还原能力为菌株特异性(315株中137株含bilR),拟杆菌科物种均未预测到bilR,双歧杆菌属中含bilR的菌株均来自非人动物粪便(图5)。
新生儿肠道中胆红素还原酶常缺失
研究团队对4296份婴儿出生后1年内的肠道宏基因组样本进行分析,按30天龄分组统计bilR缺失率:出生前3个月bilR缺失率极高,而这一时期正是新生儿黄疸的高发期;随年龄增长,缺失率逐渐下降,至1岁时基本接近成人水平(图6a)。这一趋势表明,肠道菌群中bilR的定植情况与新生儿黄疸风险密切相关。
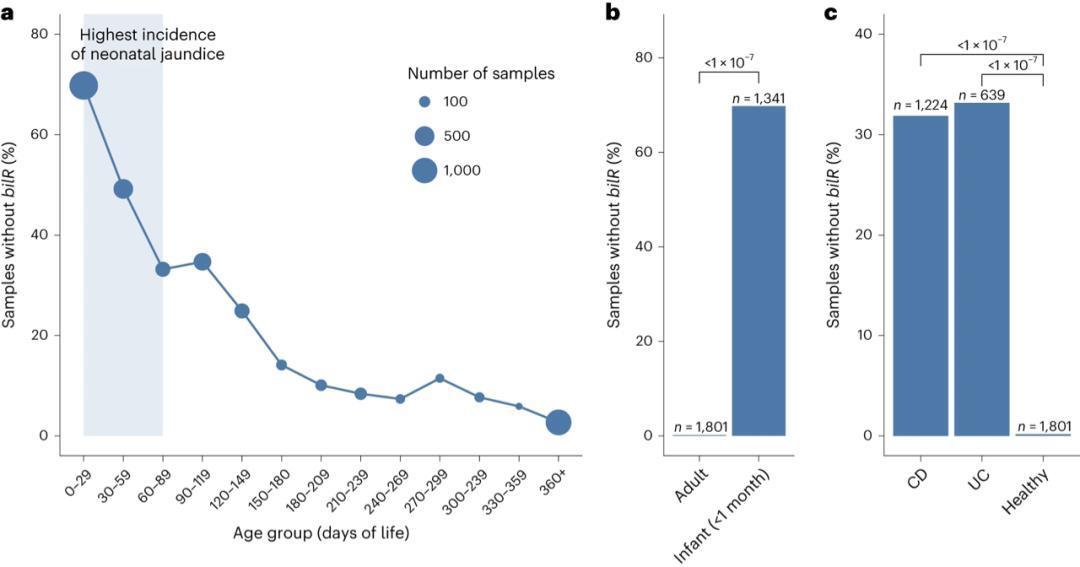
胆红素还原是人类肠道的核心功能
对1801份健康成人肠道宏基因组样本的分析显示,仅0.1%的样本缺失bilR,显著低于新生儿样本,表明胆红素还原是健康成人肠道菌群的核心功能(图6b)。而对1863份IBD患者样本的分析显示,克罗恩病(CD)和溃疡性结肠炎(UC)患者的bilR缺失率均显著高于健康成人(图6c)。已知IBD患者血清胆红素水平异常、尿胆素含量降低,且色素性胆结石发生率升高,这一结果提示肠道菌群胆红素代谢紊乱可能参与IBD的病理过程。
讨论
BilR的发现填补了血红素代谢通路的关键缺口,明确肠道微生物通过BilR催化胆红素还原为尿胆原,促进其排泄以维持胆红素稳态,其缺失或功能异常可能引发新生儿黄疸、IBD相关肝胆结石等疾病。该研究的理论价值在于首次阐明肠道微生物介导胆红素还原的分子机制,深化了对肠肝轴的理解,同时揭示了BilR的保守序列特征与进化规律;临床意义体现在为新生儿黄疸和IBD提供了新的病理解释——新生儿黄疸高发可能与早期肠道BilR阳性菌株定植不足相关,IBD患者的胆红素结石风险升高可能与bilR缺失导致的代谢紊乱相关,未来可通过补充BilR阳性菌株、调控bilR表达等微生物干预策略,预防和治疗胆红素代谢相关疾病;从应用角度看,BilR的鉴定为开发胆红素检测工具、设计靶向药物提供了新靶点。
研究还提出了未来需进一步探索的方向:一是验证胆红素二葡萄糖醛酸苷是否需先经β-葡萄糖醛酸酶解偶联富邦速配,再由BilR还原;二是鉴定尿胆原向粪胆原还原的未知酶;三是通过队列研究明确血清胆红素、粪便尿胆素类物质与BilR阳性菌株丰度的相关性,为全面解析胆红素代谢网络提供更坚实的基础。
杠杆炒股配资提示:文章来自网络,不代表本站观点。